Legame peptidico: significato e funzione nel collagene
Ultima modifica 28 Gennaio 2026 Autore: Dott.ssa Maria Grazia Lamberti
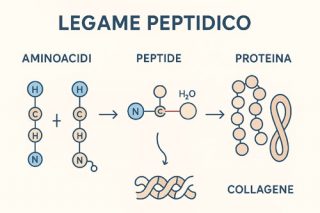
Il legame peptidico è un collegamento chimico che unisce due amminoacidi, cioè le molecole fondamentali che formano le proteine del nostro corpo. Ogni volta che mangiamo alimenti ricchi di proteine — come carne, pesce, uova o legumi — il nostro organismo scompone queste catene di amminoacidi per poi ricostruirle secondo le proprie necessità. Il collante che tiene insieme queste unità si chiama appunto legame peptidico.
Responsabili di funzioni biologiche fondamentali come la catalisi delle reazioni metaboliche, il trasporto molecolare e la replicazione del DNA, le proteine iniziano il loro percorso attraverso il legame peptidico. Fondamentale per la formazione delle catene di amminoacidi, il legame peptidico è un legame chimico di tipo covalente.
Cos’è il legame peptidico
Il legame peptidico è una tipologia di legame chimico covalente nel quale due amminoacidi si legano tra loro formando, dalla reazione di scarto, una molecola di acqua. Quest’ultima reazione, detta reazione di condensazione, è dovuta al fatto che i due amminoacidi perdono un atomo di idrogeno e uno di ossigeno e l’altro un atomo di idrogeno, nel legame tra il gruppo amminico ed il gruppo carbossilico. L’amminoacido risultante è detto dipeptide che a sua volta può formare ulteriori legami formando un polipeptide, una proteina.
Lo specifico legame che si instaura tra gli amminoacidi è unico nel rappresentare una singola proteina. Ogni catena di polipeptidi, difatti, presenta caratteristiche differenti in base a come si struttura il legame peptidico. Il posizionamento errato di un singolo polipeptide determina l’inutilità biologica della proteina formata. A costituire le proteine entra in gioco il mix di venti diversi amminoacidi; tuttavia, in tutti gli esseri viventi sono registrati oltre 500 diversi amminoacidi.
Immagina gli amminoacidi come perline di una collana. Quando due perline si uniscono, lo fanno attraverso un “gancio” chimico: il legame peptidico.
Questo legame si forma tra:
-
il gruppo carbossilico (-COOH) di un amminoacido e
-
il gruppo amminico (-NH₂) dell’amminoacido successivo.
Durante questa unione si libera una molecola d’acqua (H₂O): per questo il processo è detto reazione di condensazione o disidratazione.
Il risultato è una catena di amminoacidi collegati da legami peptidici: questa catena prende il nome di peptide. Se la catena è molto lunga, parliamo di polipeptide, e da questi si formano poi le proteine.
Dove troviamo i legami peptidici
I legami peptidici sono presenti in tutte le proteine viventi, quindi in ogni cellula del nostro corpo.
Si trovano:
-
nei muscoli, che contengono proteine come actina e miosina;
-
nella pelle, dove il collagene e l’elastina mantengono la struttura e l’elasticità;
-
nei capelli, nelle unghie, e perfino negli enzimi che regolano le reazioni biologiche.
Senza i legami peptidici, il corpo non potrebbe costruire né mantenere queste strutture fondamentali.
Come si forma un legame peptidico
La formazione del legame peptidico avviene nel ribosoma, la “fabbrica” delle proteine presente in ogni cellula.
Durante la sintesi proteica, gli amminoacidi vengono assemblati uno dopo l’altro seguendo le istruzioni contenute nel DNA.
Ogni volta che due amminoacidi si uniscono, si forma un nuovo legame peptidico e la catena cresce fino a creare una proteina completa.
La forza e la stabilità di questo legame spiegano perché le proteine siano molecole così resistenti e versatili.
Struttura e proprietà degli amminoacidi
Generalmente un amminoacido è formato da un atomo di carbonio centrale legato ad un idrogeno, ad un gruppo carbossilico, ad un gruppo amminico e ad una catena laterale (R-CHNH2COOH). Il perno della catalizzazione che dà vita alle proteine è la peptidiltransferasi. La glicina è altresì un amminoacido dove vi è la presenza di un gruppo carbossilico e di un gruppo amminico ma con la presenza sulla catena laterale di un atomo di idrogeno. Rispetto agli altri amminoacidi, la glicina non è chirale ovvero una disposizione non sovrapponibile alla sua immagine speculare.
Gli amminoacidi essenziali
Tra i 20 amminoacidi necessari nel corpo umano per la sintesi delle proteine, 8 sono definiti essenziali, ovvero sono amminoacidi non sintetizzati dal nostro organismo e che bisogna assumere attraverso la dieta. Gli amminoacidi essenziali sono la treonina, la valina, la metionina, la lisina, la leucina, l’isoleucina, il triptofano e la fenilalanina. La mancanza di questi amminoacidi determina una condizione nella quale si ferma la produzione di proteine.
La metabolizzazione degli amminoacidi essenziali attraverso la dieta predilige proteine animali considerate ad alto valore biologico; le proteine vegetali, spesso carenti di uno o più amminoacidi, sono considerate a basso valore biologico. Tra le proteine animali non considerate ad alto valore biologico vi è il collagene al quale manca l’amminoacido triptofano.
La metabolizzazione delle proteine nell’intestino è possibile grazie alla rottura del legame peptidico e la scomposizione dei singoli amminoacidi. L’assorbimento di questi amminoacidi ed il trasporto verso le cellule permette la formazione di nuovi legami ovvero nuove proteine. L’enzima responsabile di questo processo di “scomposizione” è la peptidasi.
L’importanza di una dieta corretta per la biosintesi delle proteine
La dieta è un elemento centrale nella sintesi delle proteine. Come analizzato, difatti, l’organismo umano può sintetizzare solo alcuni amminoacidi mentre altri devono essere assunti con l’alimentazione. Questa assunzione è rappresentata da proteine, siano esse animali o vegetali, che vengono “ritrasformate” con la peptidasi in amminoacidi semplici pronti a formare nuovi legami peptidici ovvero costituire nuove proteine fondamentali per l’organismo umano.
Una dieta alimentare scorretta porta a carenze di amminoacidi essenziali, necessari per sintetizzare nuove proteine ma che il corpo umano non sa produrre autonomamente. Gravi carenze possono condurre a condizioni severe soprattutto nella fase della crescita dell’individuo.
Curiosamente, il collagene è una proteina non completa perché priva dell’amminoacido triptofano. Tuttavia, resta la più abbondante nel corpo umano, essenziale per la struttura della pelle, delle ossa e dei tessuti.
Legame peptidico e collagene
Il corpo umano è una macchina perfetta che, tuttavia, è soggetta ad un deterioramento e ad un rallentamento, del tutto naturali, nel corso degli anni. La sintesi di nuove proteine come il collagene, ad esempio, diventa sempre più macchinosa e lenta: dopo i vent’anni la produzione di collagene inizia a diminuire e si intensifica un processo di degradazione dello stesso. L’effetto più evidente esteticamente è l’invecchiamento cutaneo poiché la proteina collagene rappresenta la struttura portante di molti tessuti, tra cui la pelle.
La maggior parte dei filler, che svolgono anche un’azione rivitalizzante, operano sull’idratazione cutanea e, in generale, nella creazione dell’ambiente migliore per la proliferazione ed il corretto metabolismo dei fibroblasti. Alcuni filler di recente concezione, invece, riescono a partecipare più attivamente nei processi di sintesi del collagene attraverso l’impego di collagene combinante della catena R-polipeptidica α1 che incrementa la produzione di procollagene tipo I C-Peptide nei fibroblasti. I peptidi in esame favoriscono in modo ottimale all’avvolgimento del procollagene nella tipica composizione a tripla elica all’interno del RER ovvero il reticolo endoplasmatico rugoso.
Verificata l’efficacia di prodotti estranei alla dieta e alla sintesi fisiologica si determina l’importanza di alcune sostanze nel mantenimento dell’efficienza cellulare necessaria a sintetizzare nuove proteine collagene. Al collagene combinante sono soventi affiancati altri due elementi centrali come l’acido ialuronico ad alto peso molecolare e la carbossimetilcellulosa. Questi ultimi due “ingredienti” essenziali contribuiscono a preservare le condizioni necessarie alla proliferazione dei fibroblasti e alla loro capacità di sintetizzare nuovo collagene.
In sintesi
Il legame peptidico è il filo invisibile che unisce gli amminoacidi e dà origine alle proteine che costruiscono e mantengono il nostro corpo.
Senza di esso non esisterebbero il collagene, i muscoli, gli enzimi o la pelle stessa.
Capire come funziona questo legame significa comprendere come si rinnova la vita cellulare — e perché stimolare la produzione di nuove proteine è essenziale per mantenere la pelle giovane e sana.
Fonti:
- Stefano Colonna et al, Le proteine in “I cibi della salute: le basi chimiche di una corretta alimentazione”, pp 57-73. Springer, 2012.
- Daniela Carlisi, Marianna Lauricella. Amminoacidi e proteine. In La chimica organica e le macromolecole biologiche (pp. 233-259). PICCIN, 2020.
Domande frequenti (FAQ)
1. Cos’è il legame peptidico in parole semplici?
È il collegamento chimico che unisce due amminoacidi per formare una proteina.
2. Dove si formano i legami peptidici?
Nel ribosoma, all’interno delle cellule, durante la sintesi proteica.
3. Cosa succede se il legame peptidico si rompe?
La proteina si scompone in amminoacidi più semplici, che l’organismo riutilizza per creare nuove proteine.
4. Cosa c’entra il legame peptidico con il collagene?
Il collagene è formato da catene di amminoacidi unite da migliaia di legami peptidici: più sono stabili, più la pelle è tonica.
5. Posso stimolare naturalmente la formazione di legami peptidici?
Sì: attraverso una dieta equilibrata ricca di proteine di qualità e trattamenti che stimolano la produzione di collagene.